第一章 药品注册申请受理情况
(一)总体情况
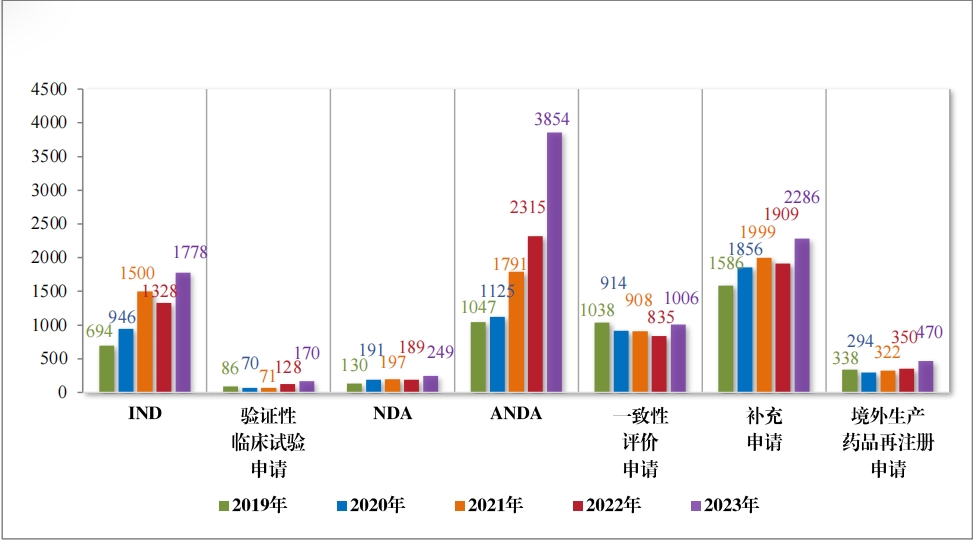
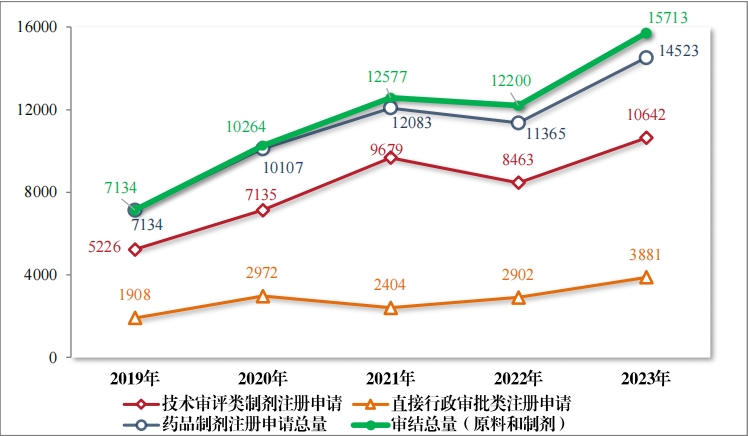
2023年,药品注册申请申报量持续增长, 药审中心受理各类注 册申请 18503 件(同比增加 35.84%,以受理号计, 下同),包括药品 制剂注册申请 16898 件(同比增加36.63%),化学原料药注册申请 1605 件(同比增加 28.09%)。 16898 件药品制剂注册申请包括技术审评类 注册申请 13153 件(同比增加 41.41%,包括 13144 件药品, 9 件药械 组合),直接行政审批类注册申请 3745 件(同比增加 22.11%,包括补充申请和一次性进口)。2019 年至2023 年注册申请受理情况详见图1。
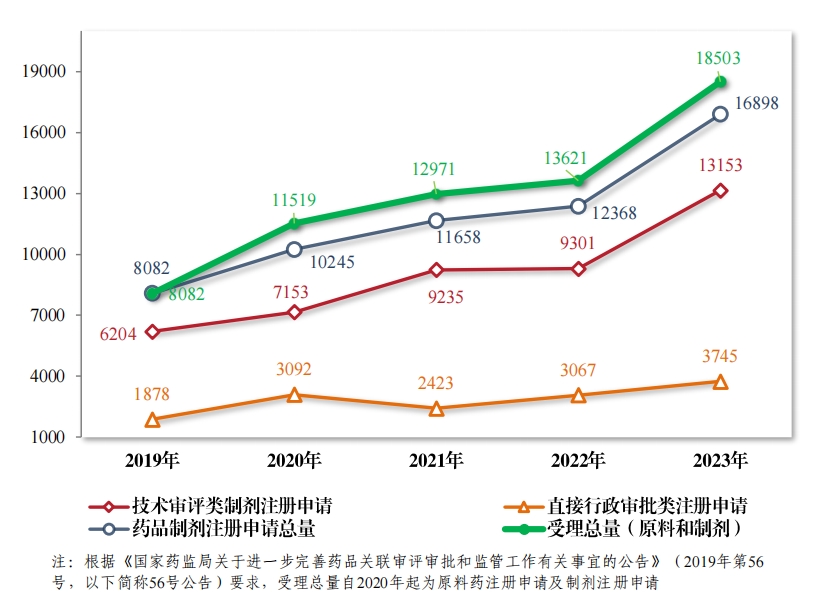
(二)技术审评类药品注册申请受理情况
2023 年受理的 13144 件技术审评类药品注册申请中, 以药品类 型统计, 中药注册申请 1163 件,同比增加 176.25%;化学药品注册 申请 9813 件, 同比增加 39.11%,占全部需技术审评的药品注册申 请受理量的 74.66%;生物制品注册申请 2168 件, 同比增加 19.12%。2019 年至 2023 年需技术审评的各药品类型注册申请受理情况详见图2。
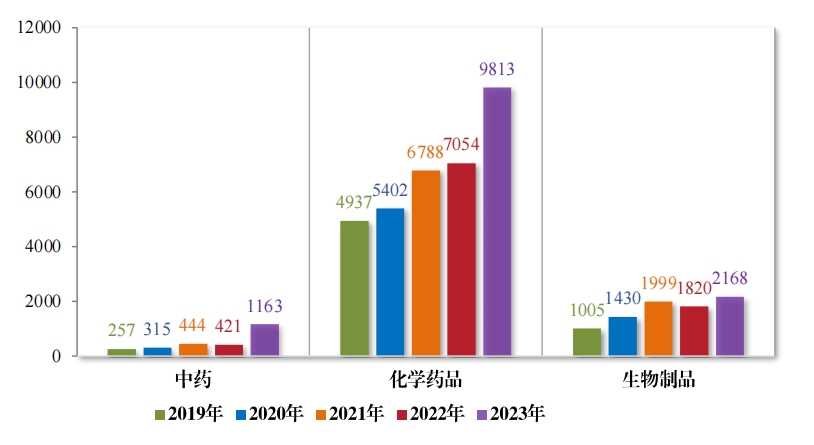
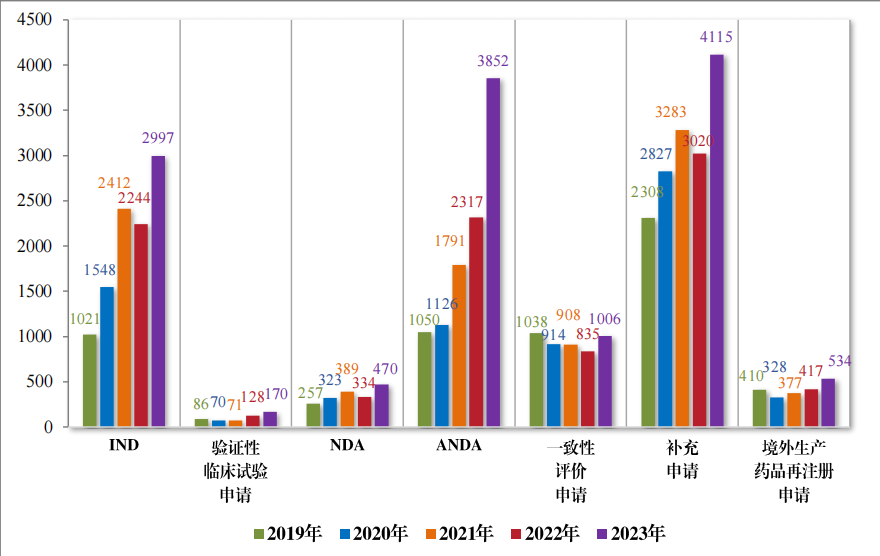
以注册申请类别统计,受理新药临床试验申请(该注册申请类别 以下简称“IND”)2997 件,同比增加 33.56%;验证性临床试验申请 170 件, 比 2022 年增加 32.81%;新药上市许可申请(该注册申请类 别以下简称“NDA”)470 件,同比增加 40.72%;同名同方药、化学仿 制药上市许可申请(该注册申请类别以下简称“ANDA”)3852 件,同 比增加 66.25%;仿制药质量和疗效一致性评价注册申请(该注册申 请类别以下简称“ 一致性评价申请” )1006 件,同比增加 20.48%;补 充申请 4115 件,同比增加 36.26%;境外生产药品再注册申请 534 件, 同比增加 28.06%。2019 年至 2023 年需技术审评的各类别注册申请受理情况详见图 3。
1.中药注册申请受理情况
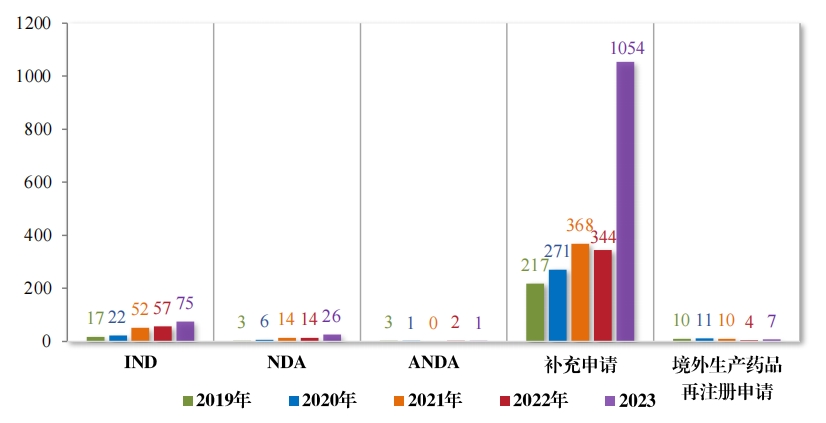
2023 年受理中药注册申请 1163 件。按审评序列统计,IND 75 件, 同比增加 31.58%;NDA 26 件,同比增加 85.71%;补充申请 1054 件, 同比增加 206.40%;ANDA 1 件,进口再注册 7 件, 与去年持平。2019年至 2023 年需技术审评的中药各类别注册申请受理情况详见图 4。
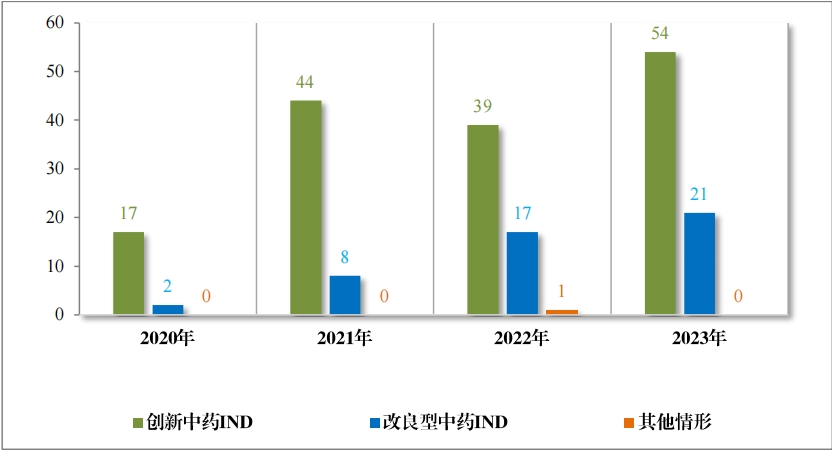
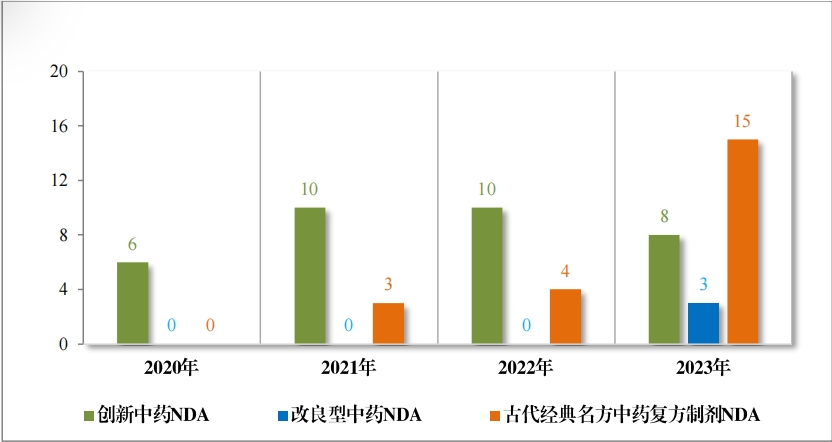
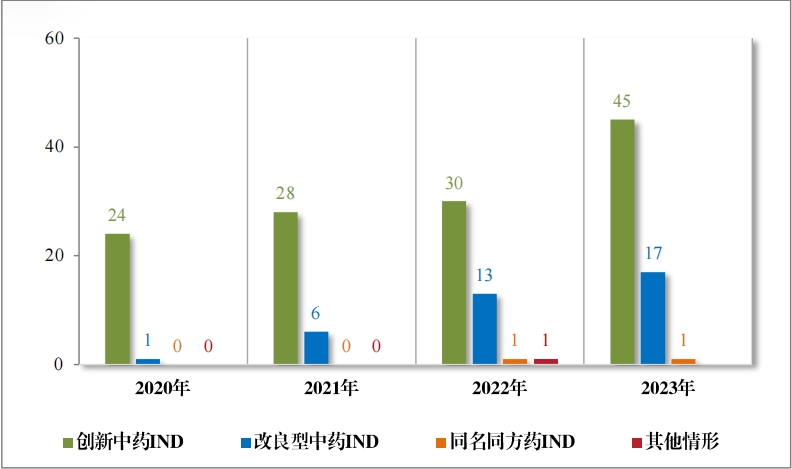
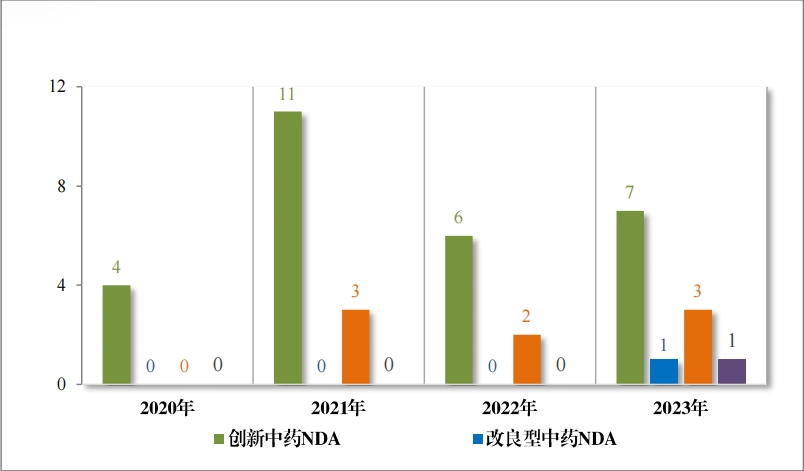
以注册分类统计,IND 75 件, 包括创新中药 IND 54 件(47 个品 种),同比增加 38.46%;改良型中药 IND 21 件(21 个品种),同比增 加 23.53%。NDA 26 件, 包括创新中药 NDA 8 件(7 个品种),与去 年持平; 改良新中药 NDA3 件(3 个品种);古代经典名方中药复方制剂 NDA 15 件(11 个品种),同比增加 275.00%。
2023 年各注册分类中药 IND 、NDA 受理情况详见表 1 ,2020 年 至 2023 年各注册分类中药 IND 受理情况详见图 5 ,2020 年至 2023年各注册分类中药 NDA 受理情况详见图 6。
2.化学药品注册申请受理情况
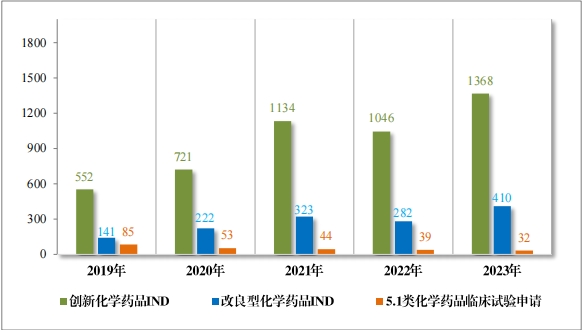
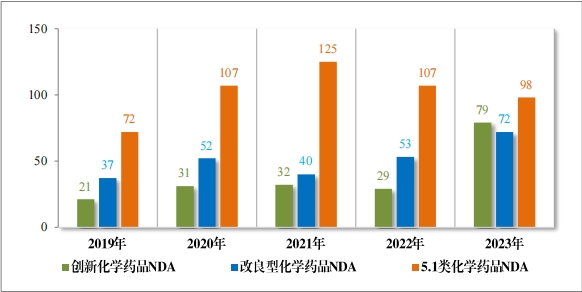
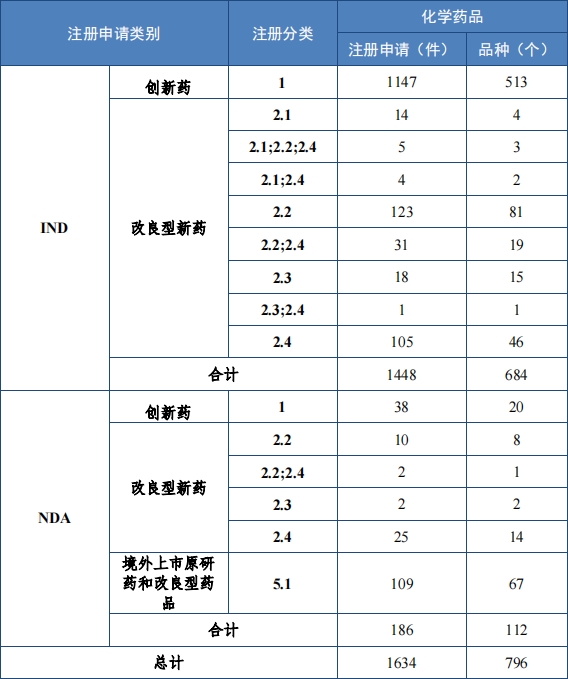
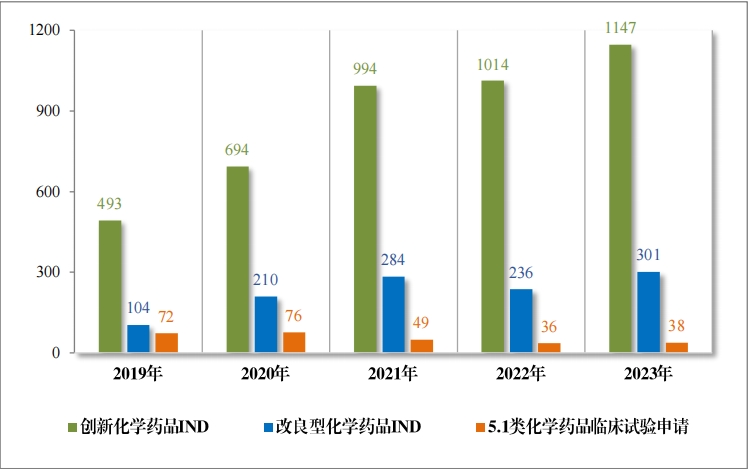
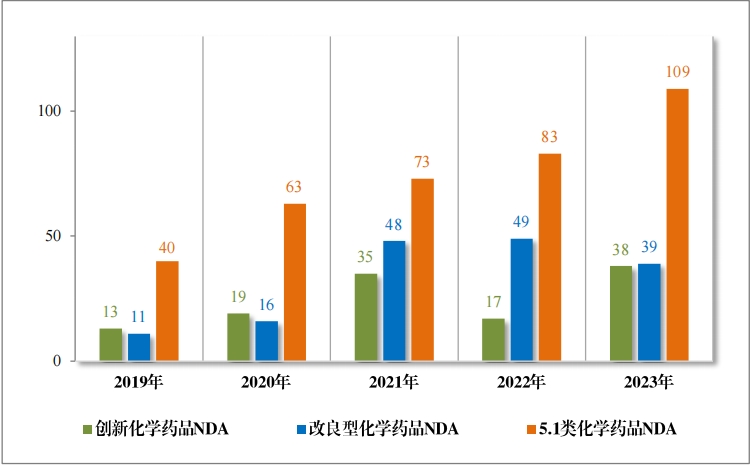
2023 年受理需技术审评的化学药品注册申请 9813 件。按审评序 列统计,IND 1778 件,同比增加 66.48%;NDA 249 件,同比增加 31.75%;ANDA 3851 件,同比增加 66.35%;一致性评价申请 1006 件,同比增加 20.48%。5.1 类化学药品1注册申请 130 件,同比减少 10.96% , 其中验证性临床试验申请2共 32 件, NDA 98 件。 2019 年至 2023 年需技术审评的化学药品各类别注册申请受理情况详见图 7。
1778 件 IND中,包括创新化学药品 IND 1368 件(600 个品种), 同比增加 30.78%;改良型化学药品 IND 410 件(229 个品种),同比 增加 45.39%。NDA 249 件中, 包括创新化学药品 NDA 79 件(55 个 品种),同比增加 172.41%;改良型化学药品 NDA 72 件(46 个品种), 同比增加 35.85%;5.1 类化学药品 NDA 98 件(62 个品种), 同比减少 8.41%。
2023 年各注册分类化学药品 IND、NDA 受理情况详见表 2,2019 年至 2023 年各注册分类化学药品临床试验申请受理情况详见图 8,2019 年至 2023 年各注册分类化学药品 NDA 受理情况详见图 9。
3.生物制品注册申请受理情况
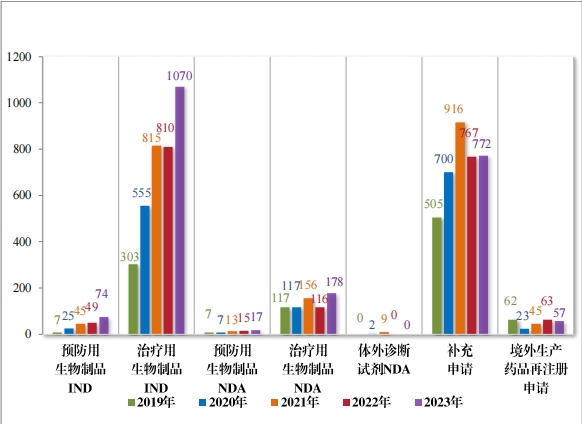
2023 年受理生物制品注册申请 2168 件,其中, 预防用生物制品 注册申请 189 件、治疗用生物制品注册申请 1969 件和体外诊断试剂10 件。
以注册申请类别统计, IND 1144 件, 同比增加 33.18%;NDA 195 件,同比增加 48.85%;补充申请 772 件,同比增加 0.65%;境外生产药品再注册申请 57 件,同比减少 9.52%。2019 年至 2023 年需技术审评的生物制品各类别注册申请受理情况详见图 10。
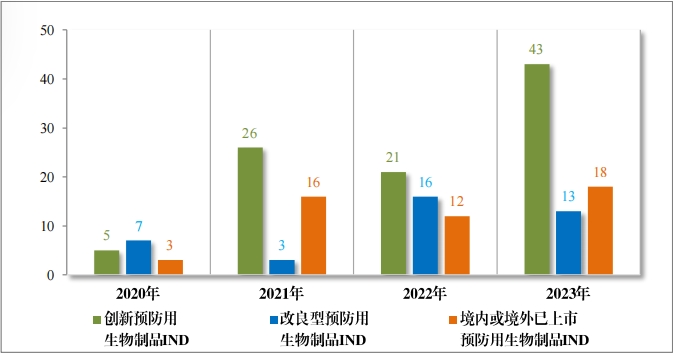
以注册分类统计,预防用生物制品 IND 74 件,包括创新预防用 生物制品 IND 43 件(34 个品种), 同比增加 104.76% ;改良型预防 用生物制品 IND13 件(11 个品种),同比减少 18.75% ;境内或境外 已上市预防用生物制品 IND 18 件(11 个品种), 同比增加 50.00% 。 预防用生物制品 NDA 17 件, 包括创新预防用生物制品 NDA 1 件(1 个品种);改良型预防用生物制品 NDA 2 件(2 个品种);境内或境外已上市预防用生物制品 NDA 14 件(6 个品种)。
2023 年各注册分类预防用生物制品 IND 、NDA 受理情况详见表 3 ,2020 年至 2023 年各注册分类预防用生物制品 IND 受理情况详见 图 11 ,2020 年至 2023 年各注册分类预防用生物制品 NDA 受理情况详见图 12。

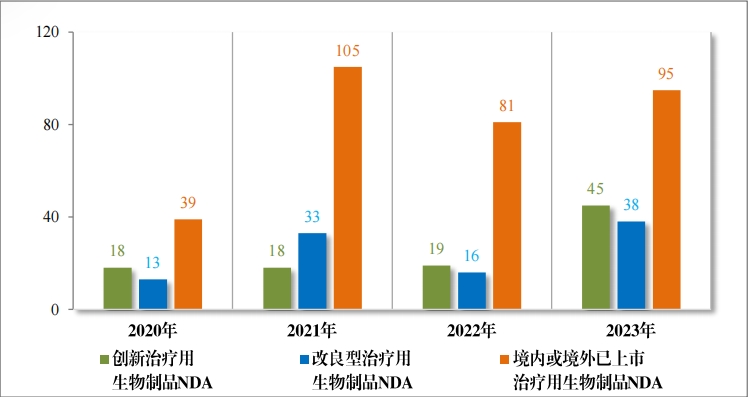
治疗用生物制品 IND 1070 件,包括创新治疗用生物制品 IND 833 件(576 个品种),同比增加 32.85%;改良型治疗用生物制品 IND146 件(75 个品种),同比增加 39.05%;境内或境外已上市治疗用生物制品 IND 91 件(46 个品种),同比增加 16.67%。
治疗用生物制品 NDA 178 件,包括创新治疗用生物制品 NDA 45 件(29 个品种),同比增加 136.84%;改良型治疗用生物制品 NDA 38 件(18 个品种), 同比增加 137.50%;境内或境外已上市治疗用生物制品 NDA 95 件(58 个品种),同比增加 17.28%。
2023 年各注册分类治疗用生物制品 IND 、NDA 受理情况详见表 4 ,2020 年至 2023 年各注册分类治疗用生物制品 IND 受理情况详见 图 14 ,2020 年至 2023 年各注册分类治疗用生物制品 NDA 受理情况详见图 15。
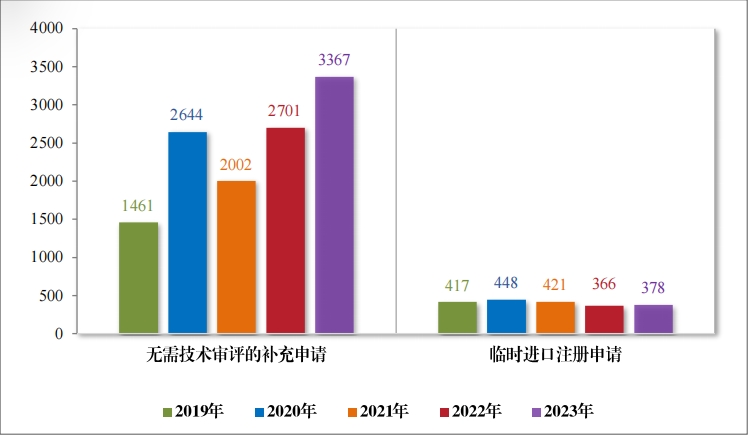
(三)直接行政审批类注册申请受理情况
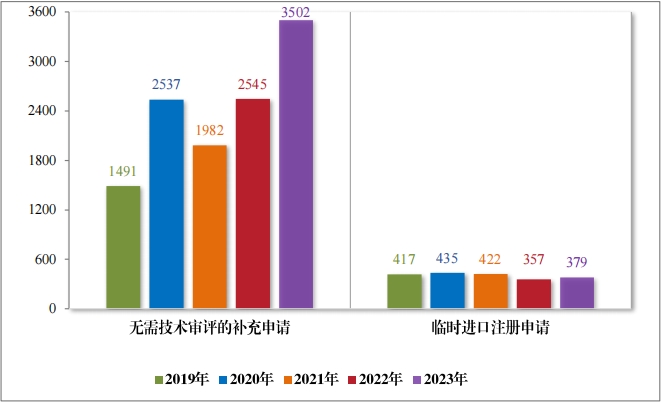
2023 年受理直接行政审批类注册申请 3745 件,同比增加22.11%; 包括无需技术审评的补充申请 3367 件,同比增加 24.66%;临时进口 注册申请 378 件,同比增加 3.28%。2019 年至 2023 年直接审批的各类别注册申请受理情况详见图 16。
第二章 药品注册申请审评审批情况
(一)总体情况
2023 年,药审中心审结3注册申请共 15713 件(同比增加 28.80%), 包括药品制剂注册申请 14523 件(同比增加 27.79%),化学原料药注 册申请 1190 件(同比增加 42.51%)。14523 件药品制剂注册申请包含 技术审评类注册申请 10642 件(同比增加 25.75%,包括 10633 件药 品, 9 件药械组合),直接行政审批类注册申请 3881 件(同比增加33.74%)。2019 年至 2023 年注册申请审结量详见图 16。

截至 2023 年底, 在审和待审的注册申请共 11059 件,其中包含 原料药注册申请 2148 件;待申请人回复补充资料的注册申请共 2153件,其中包含原料药注册申请 622 件。
(二)技术审评类注册申请审结情况
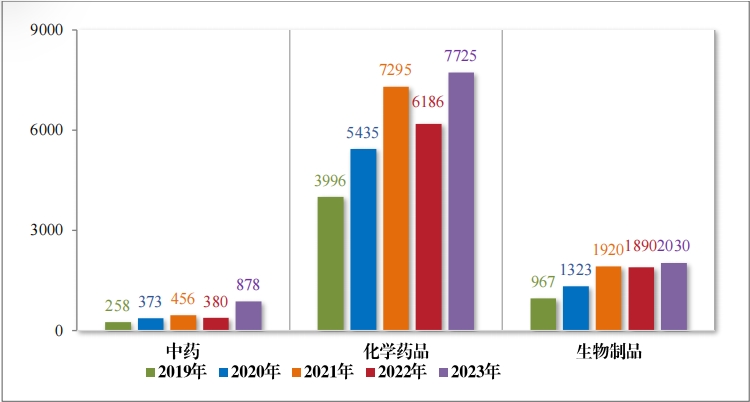
2023 年审结的 10642 件技术审评类注册申请中,按药品类型计, 中药注册申请 878 件, 同比增加 131.05%;化学药品注册申请 7725 件,同比增加 24.88%,占全部需技术审评审结量的 72.59%;生物制 品注册申请 2030 件 ,同比增加 7.41%;药械组合注册申请 9 件。2019年至 2023 年需技术审评的各药品类型注册申请审结情况详见图 17。
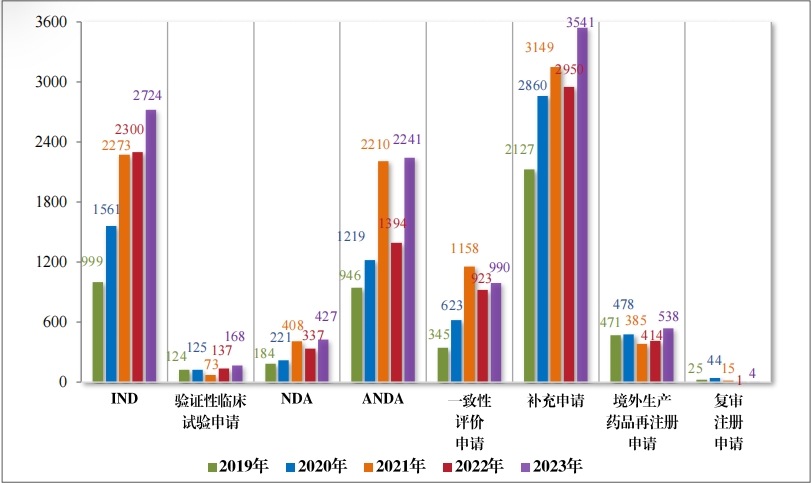
按审评序列计,2023 年审结 IND 2724 件, 同比增加 18.43%;验 证性临床试验申请 168 件,同比增加 22.63%;NDA 427 件,同比增 加 26.71%;ANDA 2241 件, 同比增加 60.76%;一致性评价申请 990 件,同比增加 7.26%;补充申请 3541 件,同比增加 20.03%;境外生 产药品再注册申请 538 件, 同比增加 29.95%。2019 年至 2023 年需技术审评的各类别注册申请审结情况详见图 18。
2023 年,药审中心采取多种措施提高审评效率,加快药品审评速度,以临床价值为导向,为患者提供更多的用药选择。
全年批准上市 1 类创新药 40 个品种(详见附件 1),其中 9 个品 种(22.5%)通过优先审评审批程序批准上市, 13 个品种(32.5%) 为品附条件批准上市, 8 个品种(20%)在临床研究阶段纳入了突破 性治疗药物程序、4 个新冠治疗药物(10%)通过特别审批程序批准上市。
全年批准罕见病用药 45 个品种(未包括化药 4 类罕见病用药), 其中 15 个品种(33.3%)通过优先审评审批程序得以加快上市(详见附件 2), 1 个附条件批准上市。
全年批准儿童用药产品 92 个品种, 包含 72 个上市许可申请,其 中 26 个品种(28%)通过优先审评审批程序得以加快上市(详见附件 3);另批准 20 个品种扩展儿童适应症, 让更多儿童患者和千万家庭从中受益。
全年批准 CAR-T 细胞治疗产品 3 个, 包括附条件批准伊基奥仑赛注射液、纳基奥仑赛注射液上市,附条件批准阿基仑赛注射液增加新适应症。
全年批准境外已上市、境内未上市的原研药品(化学药品 5.1 类、 生物制品 3.1 类) 86 个品种, 其中 62 个为新批准上市,包括 1 个纳入临床急需境外新药名单内的品种,24 个为新增适应症, 详见附件 4。
1.中药注册申请审结情况
2023 年审结中药注册申请 878 件, 同比增加 131.05%。按审评序 列计, IND 77 件, 同比增长 32.76%;NDA 21 件, 同比增加 50.00%;ANDA 1 件。 2023 年中药各类别注册申请审结情况详见表 5。
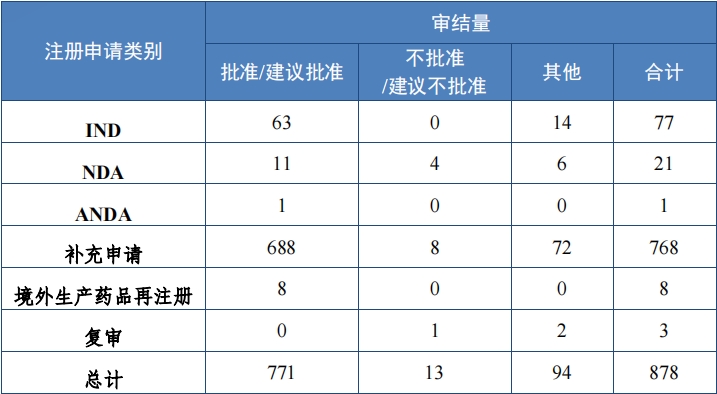
批准中药 IND 63 件,同比增长 40.00%,包括创新中药 IND 45件(39 个品种),同比增长 50.00%;改良型中药 IND 17 件(17 个品种),同比增长 30.77%;同名同方药 IND 1 件(1 个品种)。建议批准 中药 NDA 11 件(10 个品种),同比增长 37.50%,包括创新中药 NDA 7 件(6 个品种);改良型中药 NDA 1 件(1 个品种);古代经典名方 中药复方制剂 NDA 3 件(3 个品种)。建议批准中药 ANDA 1 件(1个品种),属中药同名同方药。
2023 年各注册分类中药 IND、NDA 批准/建议批准情况详见表 6, 2020 年至 2023 年各注册分类中药 IND 批准情况详见图 19 ,2020 年至 2023 年各注册分类中药 NDA 、ANDA 建议批准情况详见图 20。
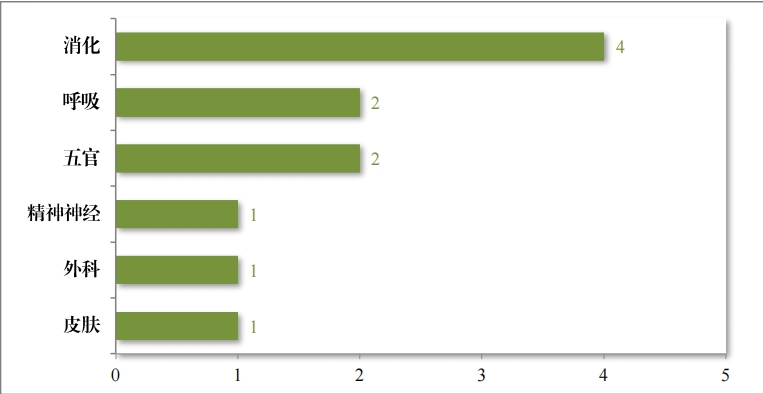
批准的 63 件中药 IND 中,涉及 13 个适应症领域,其中呼吸、 消化药物较多,占中药 IND 批准量的 46.03%。2023 年批准中药 IND的适应症领域分布情况详见图 21。

建议批准的中药 NDA 11 件中,涉及 6 个适应症领域,其中消化 药物较多,占中药 NDA 建议批准量的 36.36%。2023 年建议批准中药 NDA 的适应症领域分布情况详见图 22。
2.化学药品注册申请审结情况
2023 年审结化学药品注册申请 7725 件, 同比增加 24.88%。按审评序列计, 化学药品临床试验申请 1762 件, 同比增加 16.92%;化学药品 NDA237 件, 同比增加 21.54%;化学药品 ANDA 2240 件, 同比 增加 60.80%;化学药品一致性评价申请 990 件,同比增长 7.26%。2023 年化学药品各类别注册申请审结情况详见表 7。
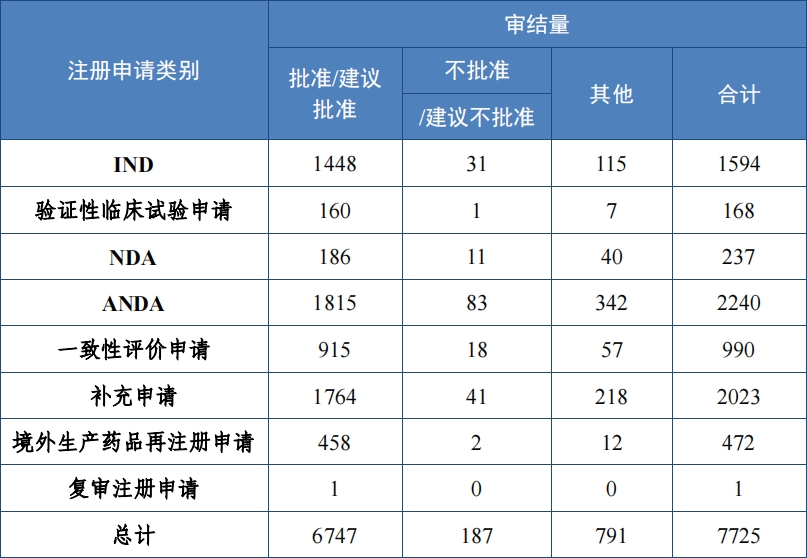
(1)新药临床试验申请和新药上市申请
批准化学药品 IND 1448 件,同比增加 15.92%,包括创新化学药 品 IND 1147 件(513 个品种),同比增加 13.12%;改良型化学药品 IND301 件(171 个品种), 同比增加 27.54%。建议批准化学药品 NDA186 件(109 个品种),同比增加 21.57%,包括创新化学药品 NDA 38 件(20 个品种),同比增加 123.53%;改良型化学药品 NDA 39 件 (25 个品种),同比减少 20.41%;5.1 类化学药品 NDA109 件(67 个品种),同比增加 31.33%。
2023 年各注册分类化学药品 IND、NDA 批准/建议批准情况详见表 8 ,2019 年至 2023 年各注册分类化学药品临床试验申请批准情况详见图 23 ,2019 年至 2023 年各注册分类化学药品 NDA 建议批准情况详见图 24。
批准的化学药品 IND 1448 件中,抗肿瘤药物占 35.98%、皮肤及 五官科药物占 12.29%, 内分泌系统药物占 7.94%。2023 年批准化学药品 IND 的适应症领域分布情况详见图 25。
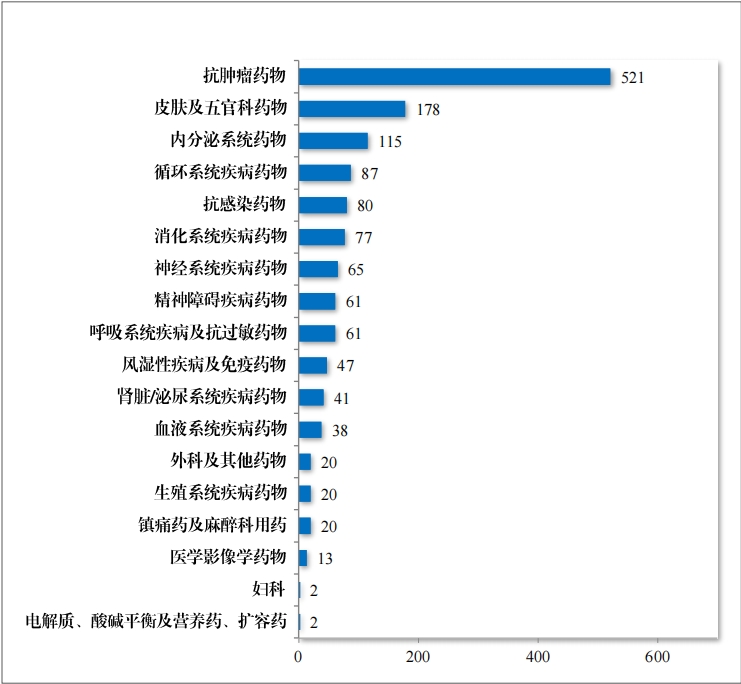
建议批准的化学药品 NDA 186 件中,抗肿瘤药物占 22.04%、内 分泌系统药物占 12.90%,消化系统疾病药物占 10.75%。2023 年建议批准化学药品 NDA 的适应症领域分布情况详见图 26。
(2)化学仿制药上市申请
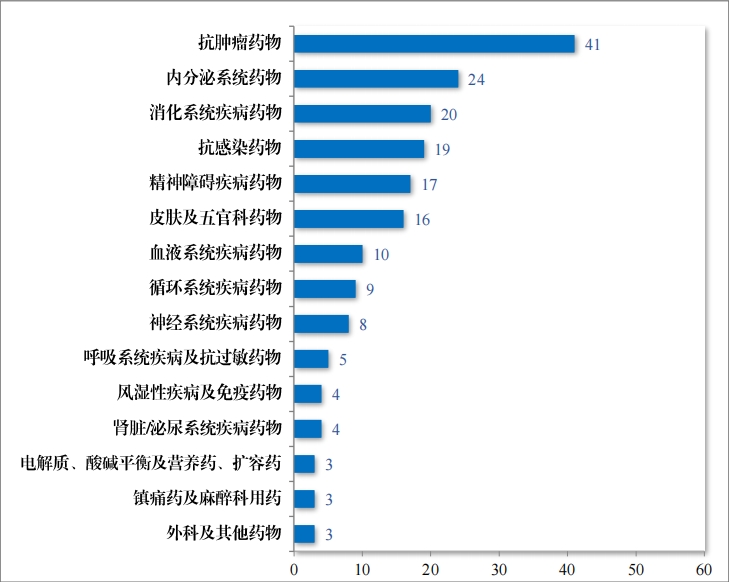
2023 年建议批准化学仿制药上市申请 1815 件,其中首仿品种 246个,有效满足了临床患者对高质量仿制药的需求。化学药品注册分类改革以来,药审中心按照与原研药品质量和疗 效一致性的要求,累计建议批准化学仿制药 4545 件(864 个品种),涉及循环、抗感染、呼吸等 17 个治疗领域,具体见图 27。
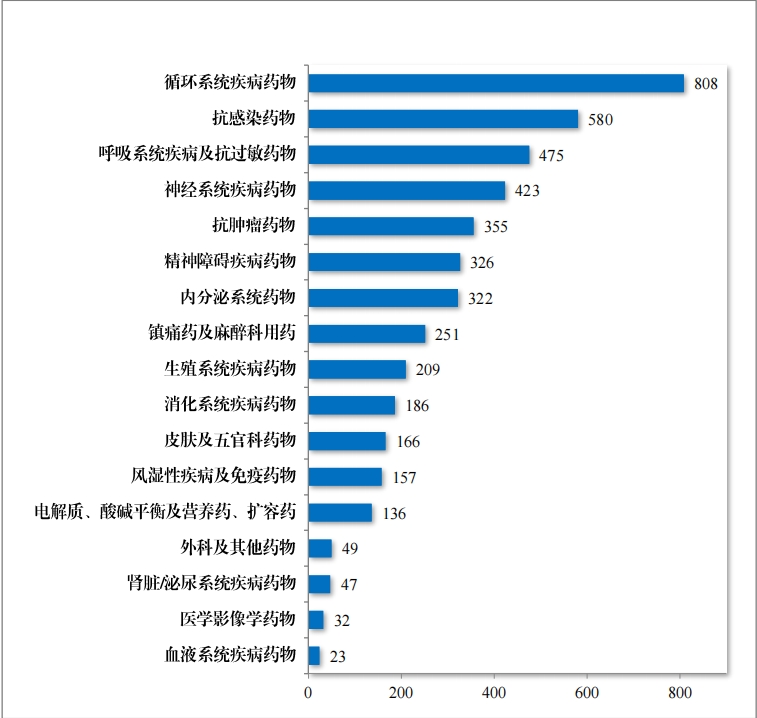
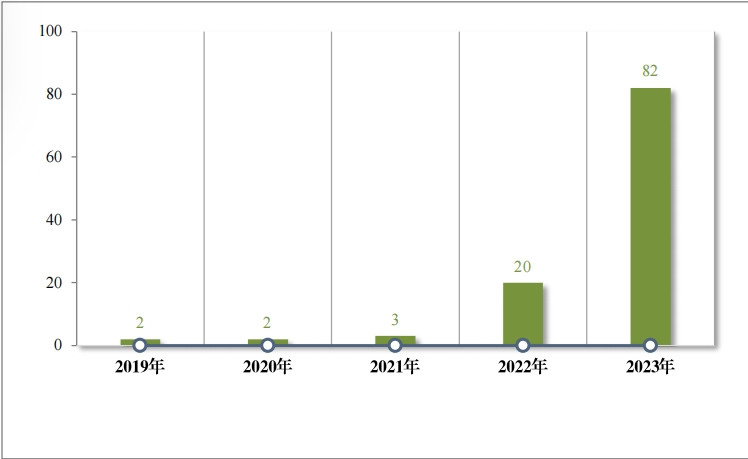
2020 年,国家卫生健康委员会、国家发展改革委员会等十二部 门发布了国家短缺药品清单,侧重在应对解决生产供应端短缺问题, 保障药品供应。为落实短缺药品清单管理制度,做好短缺药品保供稳 价工作,2023 年,药审中心共建议批准“ 国家短缺药品清单” 药品 82 件(18 个品种)。近五年累计批准上市的短缺药品共 109 件(25 个品 种),见图 28,涉及生殖、循环、电解质、肿瘤等 9 个治疗领域,具体涉及适应症请见图 29,有效的保障了短缺药品的供应。
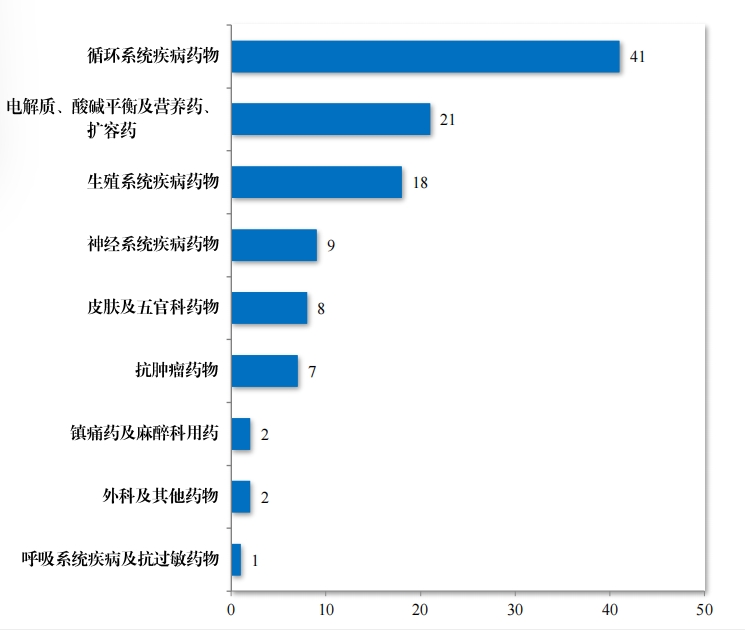
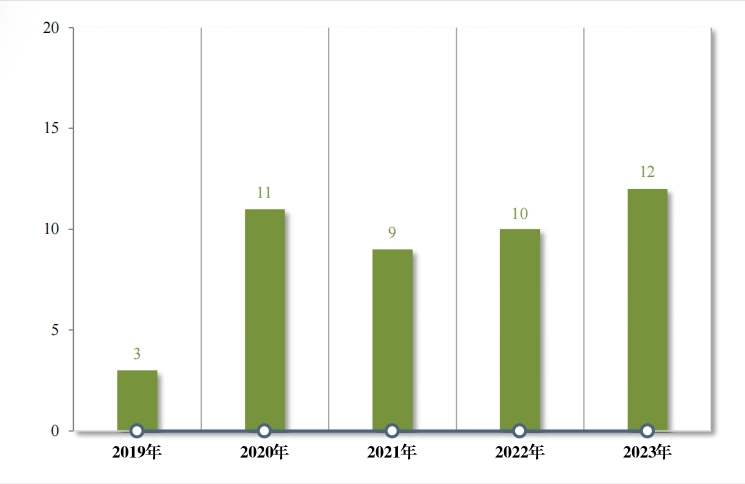
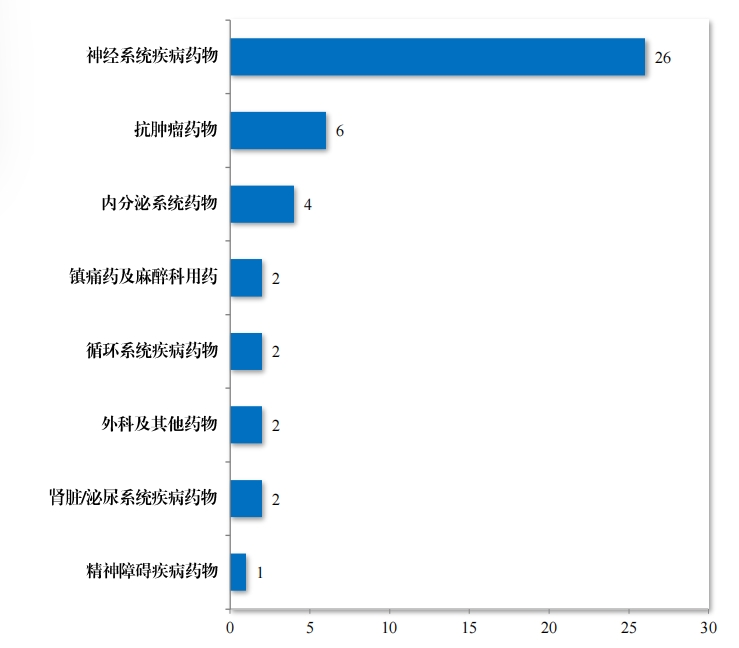
为进一步促进儿童适宜品种、剂型、规格的研发创制和申报审评, 满足儿科临床用药需求, 自 2016 年,国家卫生健康委员会同科技部、 工业和信息化部、国家局医保局和国家药监局研究制订了四批鼓励研 发申报儿童药品清单,共有 136 个品种,包括口服溶液剂、口服混悬 剂、颗粒剂等适宜儿童给药剂型。 2023 年, 药审中心建议批准属于 鼓励研发申报儿童药品清单的儿童用仿制药 12 件(8 个品种)。2019 年以来累计建议批准属于鼓励研发申报儿童药品清单的儿童用仿制 药 45 件(18 个品种),见图 30,涉及神经、抗肿瘤、内分泌等 8 个治疗领域,具体涉及适应症情况请见图 31。
(3)化学仿制药质量和疗效一致性评价工作
2023 年,药审中心持续推进化学仿制药质量和疗效一致性评价 工作,为患者提供高质量仿制药,共发布参比制剂目录 12 批,涉及 804 个品规(497 个品种)。截至 2023 年 12 月 31 日,药审中心共收 到参比制剂遴选申请信息 7955 条(3127 个品种)、自证信息 380 条 (286 个品种),累计发布 74 批参比制剂目录, 共 6714 个品规(2516个品种)。
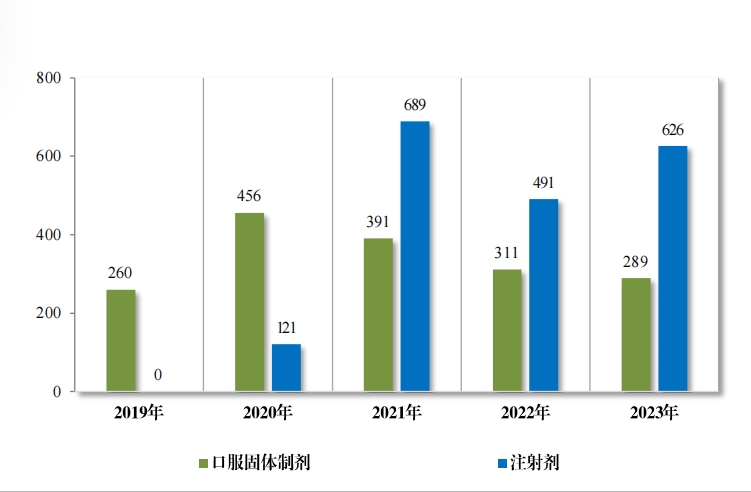
2023 年审评通过一致性评价 915 件(326 个品种),其中,口服固体制剂通过 289 件(163 个品种);注射剂通过 626 件(163 个品种)。 自化学仿制药质量和疗效一致性评价工作开展以来,累计通过一致性 评价申请共 3797 件(共计 666 个品种),其中, 口服固体制剂通过 1836 件(计 417 个品种);注射剂通过 1961 件(计 249 个品种)。2019年至 2023 年一致性评价申请批准情况详见图 32。
3.生物制品注册申请审结情况
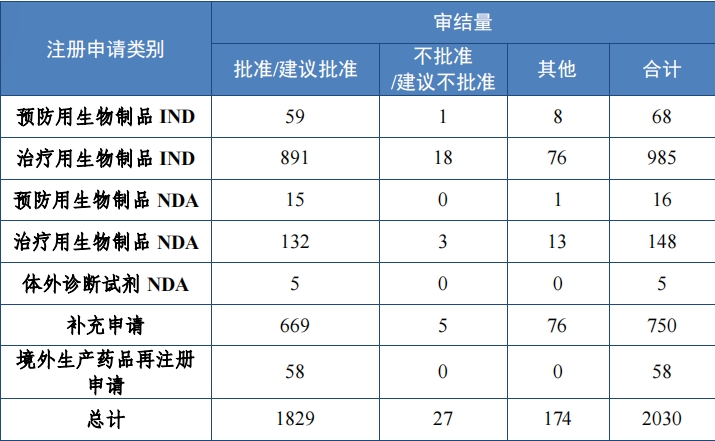
2023 年,审结生物制品注册申请 2030 件,同比增加 7.41%。其 中,预防用生物制品 179 件和治疗用生物制品 1839 件, 体外诊断试剂 12 件。
按审评序列计, IND 1053 件, 同比增加 20.76%;NDA 169 件, 同比增加 32.03%;补充申请 750 件;境外生产药品再注册申请 58 件。2023 年生物制品各类别注册申请审结情况详见表 9。
(1)预防用生物制品
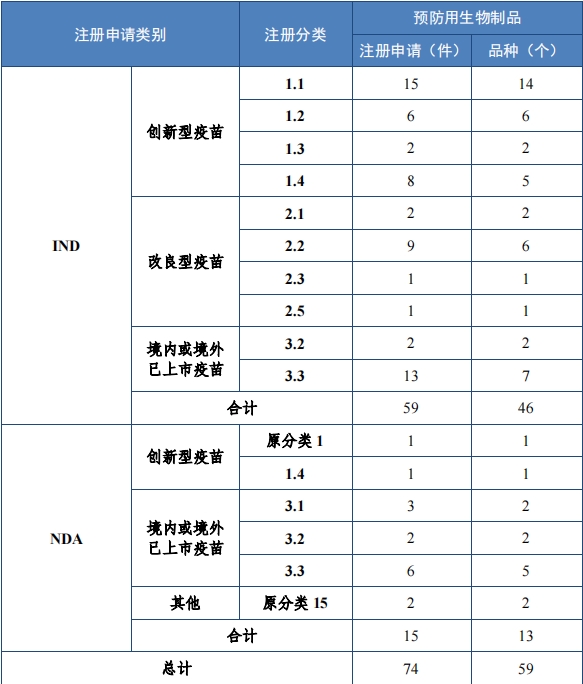
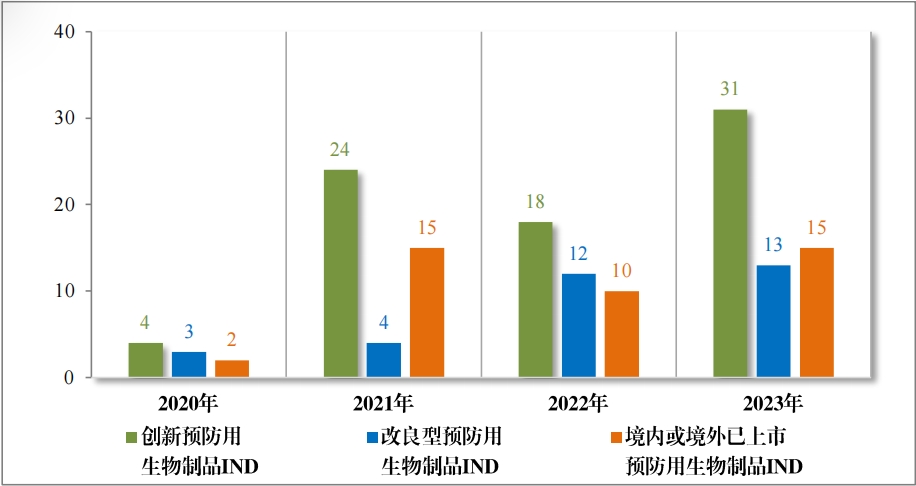
批准预防用生物制品 IND 59 件,包括创新预防用生物制品 IND 31 件(27 个品种),同比增加 72.22%;改良型预防用生物制品 IND 13 件(10 个品种), 同比增加 8.33%;境内或境外已上市预防用生物制品 IND 15 件(9 个品种),同比增加 50.00%。
建议批准预防用生物制品 NDA 15 件, 包括创新预防用生物制品 NDA2 件(2 个品种);境内或境外已上市预防用生物制品 NDA 11 件 (9 个品种),另有 2 件(2 个品种)为原《药品注册管理办法》规定的已有国家药品标准的疫苗。
2023 年各注册分类预防用生物制品 IND、NDA 批准/建议批准情 况详见表 10 ,2020 年至 2023 年各注册分类预防用生物制品 IND 批 准情况详见图 33,2020 年至 2023 年各注册分类预防用生物制品 NDA建议批准情况详见图 34。

(2)治疗用生物制品
批准治疗用生物制品 IND 891 件,包括创新治疗用生物制品 IND 695 件(510 个品种),同比增加 25.68%;改良型治疗用生物制品 IND 134 件(69 个品种),同比增加 20.72%;境内或境外已上市治疗用生物制品 IND 62 件(37 个品种),与去年持平。
建议批准治疗用生物制品 NDA 132 件,包括创新治疗用生物制 品 NDA 19 件(15 个品种),同比增加 111.11%;改良型治疗用生物制品NDA 19 件(13 个品种);境内或境外已上市治疗用生物制品NDA92 件(52 个品种),同比增加 84.00%,其中包括生物类似药(3.3 类)24 件(15 个品种)。(原 15 类 1 件, 7 类 1 件)2023 年各注册分类治疗用生物制品 IND、NDA 批准/建议批准情 况详见表 11,2020 年至 2023 年各注册分类治疗用生物制品 IND 批 准情况详见图 35,2020 年至 2023 年各注册分类治疗用生物制品 NDA建议批准情况详见图 36。
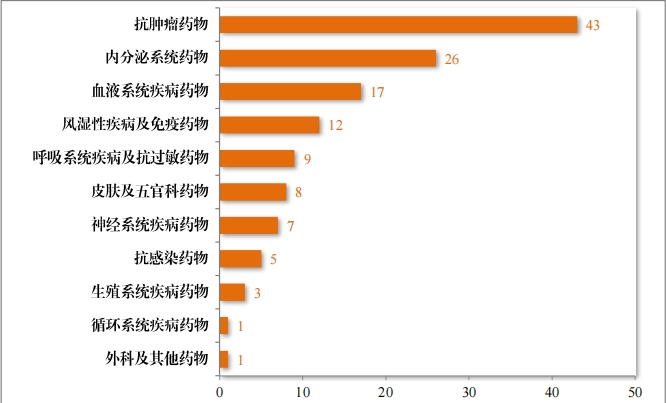
批准的治疗用生物制品 IND891 件中,抗肿瘤药物占比 53.65%, 皮肤及五官科药物占比 9.76%,血液系统疾病药物占比 6.06%。2023年批准治疗用生物制品 IND 的适应症领域分布情况详见图 37。
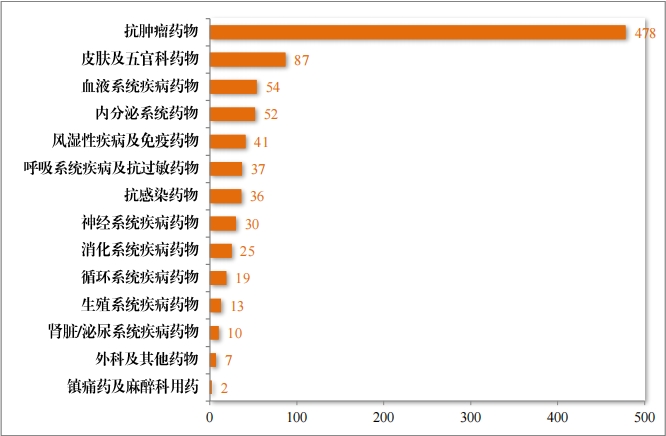
建议批准的治疗用生物制品 NDA 132 件中,抗肿瘤药物占比 32.58%,内分泌系统药物占比 19.70%,血液系统疾病药物 12.88%。 2023 年建议批准治疗用生物制品NDA 的适应症领域分布情况详见图38。
(三)直接行政审批类注册申请审结情况
2023 年审结直接行政审批类注册申请3881 件,同比增加33.74%; 其中无需技术审评的补充申请 3502 件,同比增加 37.60%;临时进口 注册申请 379 件,同比增加 6.16%。2019 年至 2023 年直接审批的各类别注册申请审结情况详见图 39。
第三章 加快新药好药上市,满足临床患者需求
2023 年度, 药审中心通过药品加快上市注册程序,加强与申请 人的沟通互动, 缩短药物研发与技术审评时间,为患者提供更多治疗 严重危及生命疾病、应对公共卫生事件的安全、有效、质量可控的临床用药。
(一)突破性治疗药物程序
药物临床试验期间,用于防治严重危及生命或者严重影响生存质 量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据 表明具有明显临床优势的创新药或者改良型新药等, 申请人可以在Ⅰ、 Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性 治疗药物程序。对于适用突破性治疗程序的药物,其临床试验期间沟 通交流包括首次沟通交流、因重大安全性问题/重大技术问题而召开 的会议、药物临床试验关键阶段会议以及一般性技术问题咨询等, 药审中心优先配置资源进行沟通交流, 加强指导并促进药物研发。
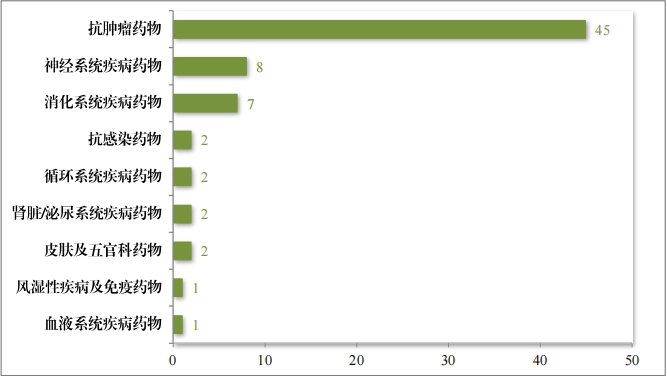
2023 年度, 共收到突破性治疗药物程序申请 286 件,同意纳入 突破性治疗药物程序 70 件(见附件 6),占申请数量的 24.5%,较 2022 年增加 43%。排名前三的分别为抗肿瘤药物、神经系统疾病药物及消化系统疾病药物,具体适应症分布情况请见图 41。
(二)附条件批准程序
药物临床试验期间,治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,以及应对重大突发公共卫生事件急需的疫苗或 者国家卫生健康委员会认定急需的其他疫苗, 经评估获益大于风险的, 可基于替代终点、中间临床终点或早期临床试验数据而附条件批准上 市。附条件批准上市的目的是缩短药物临床试验的研发时间, 使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。
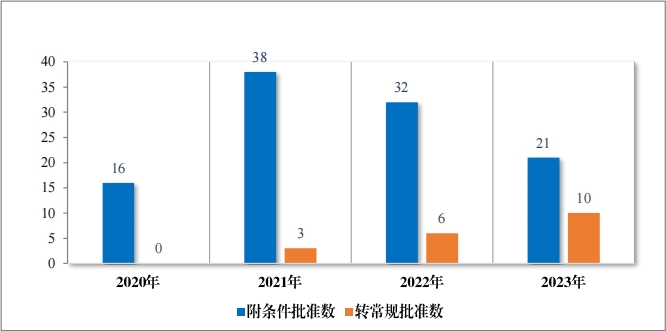
2023 年共有 21 个药品附条件批准上市,其中 16 个药品为首次 批准上市,5 个药品为新增适应症(见附件 7)。同时, 在 2023 年, 共有 10 个附条件批准上市药品完成了上市后研究,转为了常规批准。 自 2020 年《药品注册管理办法》(总局第 27 号令)实施以来, 共有 95 个药品附条件批准上市,涉及 107 个适应症,包括抗肿瘤、抗新 冠疫苗及治疗药物、血液系统疾病药物等, 其中抗肿瘤药占比最多, 为 79%,共有 19 个附条件批准上市药品完成了上市后研究, 转为了常规批准,具体请见图 42、图 43。
(三)优先审评审批程序
药品上市许可申请时, 对于以下具有明显临床价值的药品, 可以 申请适用优先审评审批程序:(一)临床急需的短缺药品、防治重大 传染病和罕见病等疾病的创新药和改良型新药;(二) 符合儿童生理 特征的儿童用药品新品种、剂型和规格;(三) 疾病预防、控制急需 的疫苗和创新疫苗;(四) 纳入突破性治疗药物程序的药品;(五) 符 合附条件批准的药品;(六) 国家药品监督管理局规定其他优先审评 审批的情形。获得适用优先审评审批程序的上市注册申请的审评时限 由常规程序的 200 日缩短为 130 日,其中临床急需的境外已上市境内未上市的罕见病药品审评时限为 70 日。
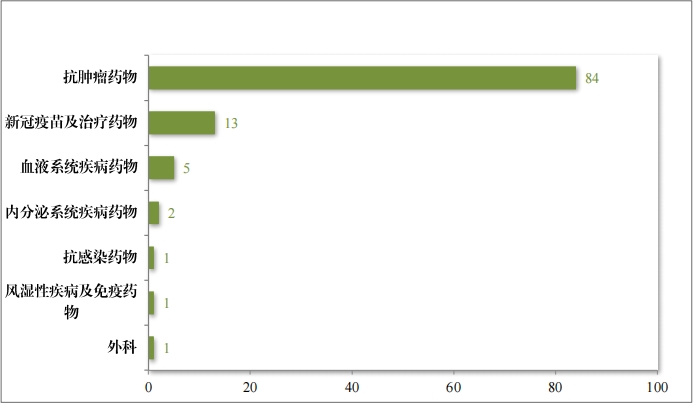
2023 年度共纳入优先审评审批注册申请 108 件(80 个品种),同 比增加 56.9%,具体纳入情况见图 44。2023 年有 85 件(59 个品种)注册申请按照优先审评审批程序批准上市。
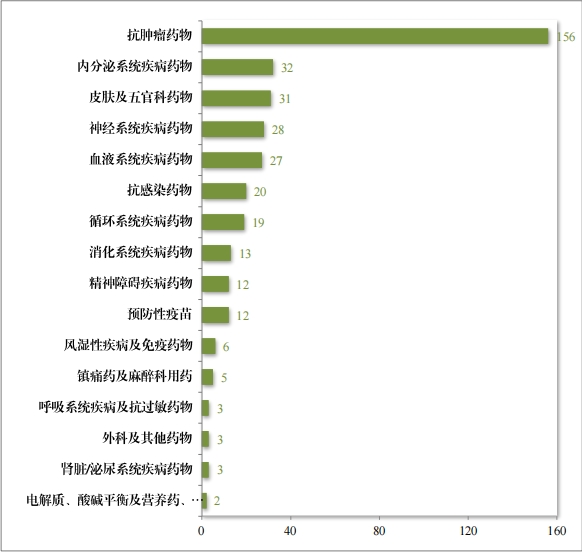
自 2020 年《药品注册管理办法》(总局第 28 号令)实施以来,共有 372 个药品注册申请纳入优先审评审批程序,涉及的抗肿瘤药物、 内分泌系统药物、皮肤及五官科药物等,其中抗肿瘤药占比最多,为42%,具体请见图 45。
第四章 药品研发与审评沟通交流情况
沟通交流是在药物研发与注册申请过程中, 申请人与药审中心审 评团队之间针对所研发产品进行的不同形式的讨论,是药审中心服务于申请人的重要举措之一。
(一)沟通交流会议申请与办理情况
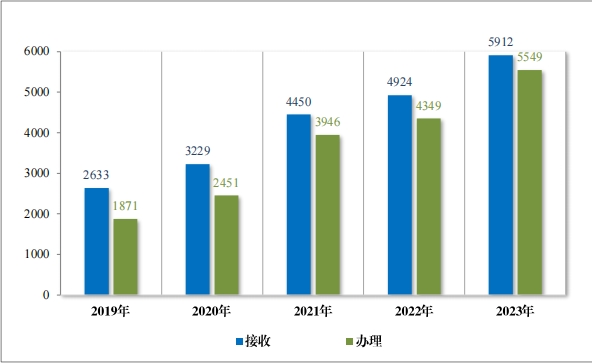
2023 年, 药审中心共接收沟通交流会议申请 5912 件, 同比增加 20.06%,为 1607 家企业的 3710 个品种(按照申请人提交沟通交流申 请时的药品名称计,下同)提供了沟通交流服务,办理沟通交流会议 申请 5549 件, 同比增加 27.59%,其中召开面对面会议/电话会议 612 个,同比增加 24.29%。自 2017 年建立沟通交流会议制度以来,为 3180 家企业的 11680 个品种在研发的关键阶段就重大问题进行了沟通指 导, 充分服务申请人, 2019 年至 2023 年接收及办理沟通交流会议申请情况详见图 46。
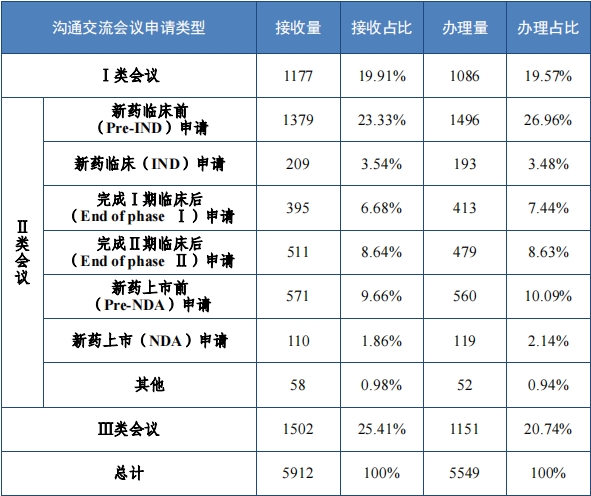
2023 年,药审中心办理沟通交流会议申请 5549 件, 召开面对面 会议或电话会议 612 次, 在药物研发关键阶段办理的Ⅱ类会议占比 54.69%,其中新药临床试验申请前(Pre-IND)申请占比 23.33%,新 药上市许可申请前(Pre-NDA)申请占比 9.66% 。2023 年沟通交流会议申请接收及办理情况详见表 12。
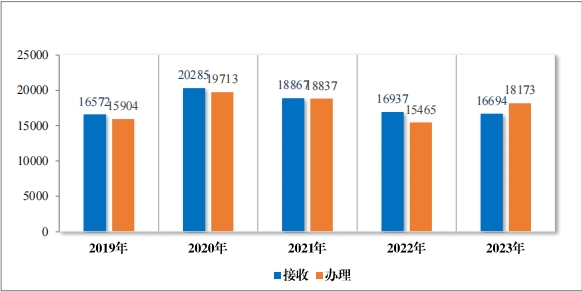
(二) 一般性技术问题咨询情况
2023 年接收一般性技术问题咨询 16694 个, 为 3831 家企业答疑 一般性技术问题咨询 18173 个,经梳理总结, 发布常见一般性技术问 题及解答共 6 批 63 个。自 2017 年开展一般性技术问题咨询以来, 为 7033 家企业在研发过程和审评过程中就 108003 个一般性技术问题进 行了答疑,总结发布 22 批 214 个共性问题4,同一企业累计提问数量分布情况详见表 13,2019 年至 2023 年接收及办理一般性技术问题咨询量详见图 47。
第五章 药品研发指导原则方面工作
(一)持续完善审评标准体系建设
2023 年药审中心制修订指导原则 74 个,新发布指导原则 60 个(详见附件 8),累计发布药品技术指导原则达 482 。
1.聚焦国际前沿技术领域, 推动指导原则体系与国际先进技术标准深度融合
为推动 ICH Q13 指导原则在我国落地实施,发布了国内首个《化 药口服固体制剂连续制造技术指导原则(试行)》。持续完善我国真实 世界证据指导原则体系,继真实世界证据、真实世界数据的评价等技 术要求,今年发布实施了《药物真实世界研究设计与方案框架指导原 则(试行)》真实世界证据支持药物注册申请的沟通交流指导原则试行)2 项技术指导原则。
加快完善放射性治疗药物评价体系, 制定发布了《放射性体内治疗药物临床评价技术指导原则》《放射性治疗药物非临床研究技术指导原则(征求意见稿)》《放射性标记人体物质平衡研究技术指导原则(征求意见稿)》《放射性化学仿制药药学研究技术指导原则(征求意见稿)》等 4 项技术指导原则, 推动相关产品加快研发上市。
加快完善细胞和基因治疗技术评价体系,制定发布了肿瘤主动免 疫治疗产品、人源性干细胞、溶瘤病毒、基因治疗治疗血友病等 5 项技术指导原则。
2.凝聚国际共识及监管实践,持续完善创新药物研发技术评价体系,有效缩短新药研发上市进程
首次将“ 以患者为中心” 和基于“ 动物法则(Animal Rule)” 药物注 册理念纳入指导原则, 标志着我国药物研发策略进入了新阶段。持续 完善创新药物研发共性技术要求,发布实施了新药 III 期临床试验前 药学沟通交流、化药复方药物临床试验设计、新药获益-风险评估、 临床试验期间安全性信息评价、药物性肝损伤、单臂试验临床应用等7 项技术指导原则。
3.探索和丰富“ 三结合” 注册审评证据体系,推动符合中医药特点的技术标准体系建设
围绕构建和完善“ 三结合” 审评证据体系的工作任务,针对中药研 发瓶颈和热点、难点问题, 以问题为导向, 不断创新工作方法,依托 中药监管科学研究,广泛开展学术交流,充分发挥外部专家的作用, 结合审评案例解剖麻雀,总结特点和规律, 研究形成技术标准。2023 年, 发布《基于人用经验的中药复方制剂新药药学研究技术指导原则 (试行)》等 5 项指导原则,同时,聚焦具有中医药治疗临床优势和 特点的适应症,起草制定了糖尿病视网膜病变、紧张型头痛、小儿便 秘等适应症临床研究技术指导原则,加快符合中药特点的疗效评价审评标准体系建设。
4.加大力度解决公众及特殊群体的用药需求问题,提高常见疾病药物研发评价体系覆盖率
加快儿童用药研发进程,制定发布了《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则》《成人用药数据外推至儿科人群的定量方法学指导原则(试行)》;为解决特殊群里用药吞咽困难, 制定发布了《咀嚼片(化学药品)质量属性研究技术指导原则(试行)》; 为加强说明书和标签规范管理,制定发布了《化学药品说明书及标签药学相关信息撰写指导原则(试行)》等 4 项技术指导原则。
首次推出《人乳头瘤病毒疫苗临床试验技术指导原则(试行)》, 制定发布了首个《罕见疾病药物开发中疾病自然史》;在抗肿瘤药物 领域制定发布了儿童抗肿瘤、晚期前列腺癌、卵巢癌 3 项技术指导原 则; 在血液系统疾病领域制定发布了慢性淋巴细胞白血病、急性髓系 白血病 2 项技术指导原则; 在内分泌系统、抗感染及抗病毒药物、消 化系统疾病等领域制定发布了原发性胆汁性胆管炎、成人 2 型糖尿病、慢性乙型肝炎病毒感染、非阿片类术后镇痛药物等 6 项技术指导原则。
5.总结仿制药申报共性问题,推动仿制药高质量发展
制定了国内外首个《化学药品仿制药溶液型滴眼剂药学研究技术 指导原则》,针对产品安全性和质量可控性关键指标,制定发布了微 生物限度、化学合成多肽、阿片类口服固体仿制药防滥用共 3 项技术指导原则。
(二) ICH 指南文件的转化实施
一是加快与国际药品注册技术要求接轨,逐步实现全球同步注册、 同步研发。 2017 年 6 月国家局加入 ICH 前, ICH 共发布了 57 个指导 原则, 除《Q4B:药典》和《Q6B:质量标准:生物技术产品及生物 制品的检查方法及可接受标准》2 个 ICH 指导原则将在 2025 年版《中国药典》中逐步实施外,其余 55 个 ICH 指导原则均以发布适用公告、接受并翻译指导原则原文的形式实现充分实施。加入 ICH 之后至2023 年 12 月, NMPA 积极选派专家参与了对旧版 ICH 指导原则的修订或 增补的国际协调工作, 共计 13 个, 并参与制定新的 ICH 指导原则 11 个, 国家局均已原文采纳、充分实施。国家局已基本完成 ICH 当前 全部 68 个指导原则的落地实施工作, 这为中国患者可以及时分享全球药物创新的最新成果,用上放心的高质量药品奠定了基础。
二是全面参与 ICH 议题国际协调。截至 2023 年 12 月, ICH 正 在活跃的协调议题共 32 个(详见附件 9),其中涉及有效性(Efficacy) 指导原则 8 个, 质量(Quality)指导原则 9 个,安全性(Safety)指 导原则 2 个,多学科(Multidiscipline)指导原则 10 个, 另有 3 个讨 论组。国家局参与了每个 ICH 活跃议题的技术讨论和指导原则起草 工作, 并在国际协调过程中积极分享交流国内监管经验,了解借鉴其 他监管机构监管良好实践。例如在参与 ICH M13 口服速释制剂生物 等效性系列指导原则的协调过程中,结合中国丰富的仿制药审评和监管经验, 国家局 ICH 专家踊跃发言,及时提供案例支持。
三是紧跟国际学术前沿,及时引入转化 ICH 新理念、新方法、 新工具、新标准。为适应制药产业和先进制造、纳米药物、人工智能 等领域新兴技术的发展趋势, ICH 近年来协调的技术指南将对后续监 管理念和监管方式带来调整。例如临床试验全球化、新的试验设计和 新技术的应用推动了药物临床试验质量管理规范(GCP)的革新,ICH 正在修订的 E6(R3)将提供更多的灵活性,提高患者参加临床试验的便利性; 而 ICH 正在修订的《M4Q(R2):人用药品注册通用技术文档: 质量》指导原则,将对药学注册申报资料的文件格式和组织框架进行重构,将为监管机构和业界带来一场变革。